El hidrógeno es un elemento químico de número atómico 1 y representado por el símbolo H Con una masa atómica del 1,00794 (7) u, el hidrógeno es el elemento más ligero. Por lo general, se presenta en su forma molecular, formando el gas diatómico (H2) en condiciones normales. Este gas es inflamable, incoloro, inodoro, no metálico e insoluble en agua.
El nitrógeno es un elemento químico, de número atómico 7, símbolo N y que en condiciones normales forma un gas diatómico (nitrógeno diatómico o molecular) que constituye del orden del 78% del aire atmosférico
El oxígeno es un elemento químico de número atómico 8 y representado por el símbolo O. Su nombre proviene de las raíces griegas ὀξύς (oxys) («ácido», literalmente «punzante», en referencia al sabor de los ácidos) y –γόνος (-gonos) («productor», literalmente «engendrador»), porque en la época en que se le dio esta denominación se creía, incorrectamente, que todos los ácidos requerían oxígeno para su composición. En condiciones normales de presión y temperatura, dos átomos del elemento se enlazan para formar el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Esta sustancia comprende una importante parte de la atmósfera y resulta necesaria para sostener la vida terrestre.
CONFIGURACION ELECTRONICA
En física y química, la configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un producto de orbitales antisimetrizadas. La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.
CADENAS CARBONATADAS
Una cadena carbonada es el esqueleto de prácticamente todos los compuestos orgánicos y está formada por un conjunto de varios átomos de carbono, unidos entre sí mediante enlaces covalentes carbono-carbono y a la que se unen o agregan otros átomos como hidrógeno, oxígeno o nitrógeno, formando variadas estructuras, lo que origina infinidad de compuestos diferentes.
La facilidad del carbono para formar largas cadenas es casi específica de este elemento y es la razón del elevado número de compuestos de carbono conocidos, si lo comparamos con compuestos de otros átomos. Las cadenas carbonadas son bastante estables y no sufren variación en la mayoría de las reacciones orgánicas.
ENLACES QUIMICOS
Un enlace químico es el proceso químico responsable de las interacciones entre átomos y moléculas,que tiene una estabilidad en los compuestos químicos diatómicos y poliatómicos.
los químicos suelen apoyarse en la fisicoquímica o en descripciones cualitativas
En general, el enlace químico fuerte está asociado en la transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos —que forman la mayor parte del ambiente físico que nos rodea— está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
Las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.
Enlace covalente
El enlace covalente polar es intermediado en su carácter entre un enlace covalente y un enlace iónico. Los átomos enlazados de esta forma tienen carga eléctrica neutra.Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres pares de electrones, o cuádruples cuando comparten cuatro pares de electrones.
Los enlaces covalentes no polares se forman entre átomos iguales, no hay variación en el número de oxidación. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.
En otras palabras, el enlace covalente es la unión entre átomos en donde se da un compartimiento de electrones, los átomos que forman este tipo de enlace son de carácter no metálico. Las moléculas que se forman con átomos iguales (mononucleares) presentan un enlace covalente pero en donde la diferencia de electronegatividades es nula.
Se presenta entre los elementos con poca diferencia de electronegatividad (< 1.7), es decir cercanos en la tabla periódica de los elementos químicos o bien, entre el mismo elemento para formar moléculas diatomicas.
Enlace iónico o electrovalente
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad, pero una diferencia sobre 2.0 suele ser iónica, y una diferencia menor a 1.5 suele ser covalente. En palabras más sencillas, un enlace iónico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un catión y un anión) o dicho de otra forma, aquel en el que un elemento más electronegativo atrae a los electrones de otro menos electronegativo. El enlace iónico implica la separación en iones positivos y negativos. Las cargas iónicas suelen estar entre -3e a +3e.1) Se presenta entre los elementos con gran diferencia de electronegatividad (>1.7), es decir alejados de la tabla periódica: entre metales y no metales. 2) Los compuestos que se forman son sólidos cristalinos con puntos de fusión elevados. 3) Se da por TRANSFERENCIA de electrones: un átomo PIERDE y el otro 'GANA'. 4) Se forman iones (cationes y aniones).
Enlace covalente coordinado
El enlace covalente coordinado, algunas veces referido como enlace dativo, es un tipo de enlace covalente, en el que los electrones de enlace se originan sólo en uno de los átomos, el donante de pares de electrones, o base de Lewis, pero son compartidos aproximadamente por igual en la formación del enlace covalente. Este concepto está cayendo en desuso a medida que los químicos se pliegan a la teoría de orbitales moleculares. Algunos ejemplos de enlace covalente coordinado existen en nitronas y el borazano. El arreglo resultante es diferente de un enlace iónico en que la diferencia de electronegatividad es pequeña, resultando en una covalencia. Se suelen representar por flechas, para diferenciarlos de otros enlaces. La flecha muestra su cabeza dirigida al aceptor de electrones o ácido de Lewis, y la cola a la base de Lewis. Este tipo de enlace se ve en el ion amonio.NOMENCLATURA DE ENLCES DE CARBON
Hidrocarburos simples
Como ya dijimos, los hidrocarburos simples son compuestos orgánicos que sólo contienen carbono e hidrógeno. Estos hidrocarburos simples vienen en tres variedades (llamadas alcanos, alquenos y alquinos) dependiendo del tipo de enlace carbono-carbono (sencillo, doble o triple) que ocurre en la molécula.
Alcanos
Los alcanos son la primera clase de hidrocarburos simples y contienen sólo enlaces sencillos de carbono-carbono. Para nombrarlos, se combina un prefijo, que describe el número de los átomos de carbono en la molécula, con la raíz que termina en “ano”.
He aquí los nombres y los prefijos para los primeros diez alcanos.
| Átomos de carbono |
Prefijo
|
Nombre de alcanos
|
Fórmula Química
|
Fórmula semidesarrollada
|
1
| Meth | Metano | CH4 | CH4 |
2
| Eth | Etano | C2H6 | CH3CH3 |
3
| Prop | Propano | C3H8 | CH3CH2CH3 |
4
| But | Butano | C4H10 | CH3CH2CH2CH3 |
5
| Pent | Pentano | C5H12 | CH3CH2CH2CH2CH3 |
6
| Hex | Hexano | C6H14 | CH3CH2CH2CH2 CH2CH3 |
7
| Hept | Heptano | C7H16 | CH3CH2CH2CH2CH2CH2CH3 |
8
| Oct | Octano | C8H18 | CH3CH2CH2CH2CH2CH2CH2CH3 |
9
| Non | Nonano | C9H20 | CH3CH2CH2CH2CH2CH2CH2CH2CH3 |
10
| Dec | Decano | C10H22 | CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 |
La fórmula química para cualquier alcano se encuentra en la expresión CnH2n + 2, donde n es el número de carbonos que se enlazan.
Ejemplo para un alcano que tenga seis carbonos (un hexano):
CnH2n + 2
Reemplazamos n por el seis y tenemos
C6H2(6) + 2
C6H12 + 2
C6H14
que según su fórmula semidesarrollada es CH3CH2CH2CH2CH2CH3
La fórmula semidesarrollada, para los primeros diez alcanos de la tabla, muestra cada átomo de carbono y los elementos a los que están unidos.
Los alcanos simples comparten muchas propiedades en común. Todos entran en reacciones de combustión con el oxígeno para producir dióxido de carbono y agua de vapor. En otras palabras, muchos alcanos son inflamables. Esto los convierte en buenos combustibles. Por ejemplo, el metano es el componente principal del gas natural y el butano es un fluido común más liviano.
Alquenos
La segunda clase de hidrocarburos simples son los alquenos, formados por moléculas que contienen por lo menos un par de carbonos de enlace doble.
Para nombrarlos, los alquenos siguen la misma convención que la usada por los alcanos. Un prefijo (para describir el número de átomos de carbono) se combina con la terminación “eno” para denominar un alqueno (no puede haber un meteno ya que tendría solo un átomo de carbono). El eteno (que sería el primer alqueno), por ejemplo, consiste de dos moléculas de carbono unidas por un enlace doble.
La fórmula química para los alquenos simples sigue la expresión CnH2n. Debido a que uno de los pares de carbono está doblemente enlazado, los alquenos simples tienen dos átomos de hidrógeno menos que los alcanos.
Alquinos
Los alquinos son la tercera clase de hidrocarburos simples y son moléculas que contienen por lo menos un par de enlaces de carbono, que en este caso será triple. Tal como los alcanos y alquenos, los alquinos se denominan al combinar un prefijo (que indica el número de átomos de carbono) con la terminación “ino” para denotar un enlace triple.
La fórmula química para los alquinos simples sigue la expresión CnH2n-2.
Funciones oxigenadas
A continuación, un cuadro resumen de los grupos funcionales (con su correspondiente función química) donde participan átomos de carbono, hidrógeno y oxígeno.Presencia de algún enlace carbono-oxígeno: sencillo (C-O) o doble (C=O)
| Grupo funcional |
Función o compuesto
|
Fórmula
|
Estructura
|
Prefijo
|
Sufijo
|
Grupo hidroxilo
|
Alcohol
|
R-OH
|
hidroxi-
|
-ol
| |
Grupo alcoxi (o ariloxi)
|
Éter
|
R-O-R'
|
-oxi-
|
R-il R'-il éter
| |
Grupo carbonilo
|
Aldehído
|
R-C(=O)H
| 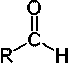 |
oxo-
|
-al
-carbaldehído |
Cetona
|
R-C(=O)-R'
|
oxo-
|
-ona
| ||
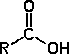
Grupo carboxilo
|
Ácido carboxílico
|
R-COOH
|
carboxi-
|
Ácido -ico
| |
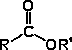
Grupo acilo
|
Éster
|
R-COO-R'
|
-iloxicarbonil-
|
R-ato de R'-ilo
|







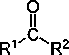
No hay comentarios.:
Publicar un comentario